مرض باركينسون (الشلل الرعاش) قد يبدأ في الأمعاء قبل أن يؤثِر في الدماغ
22 يونيو، 2017
الطب
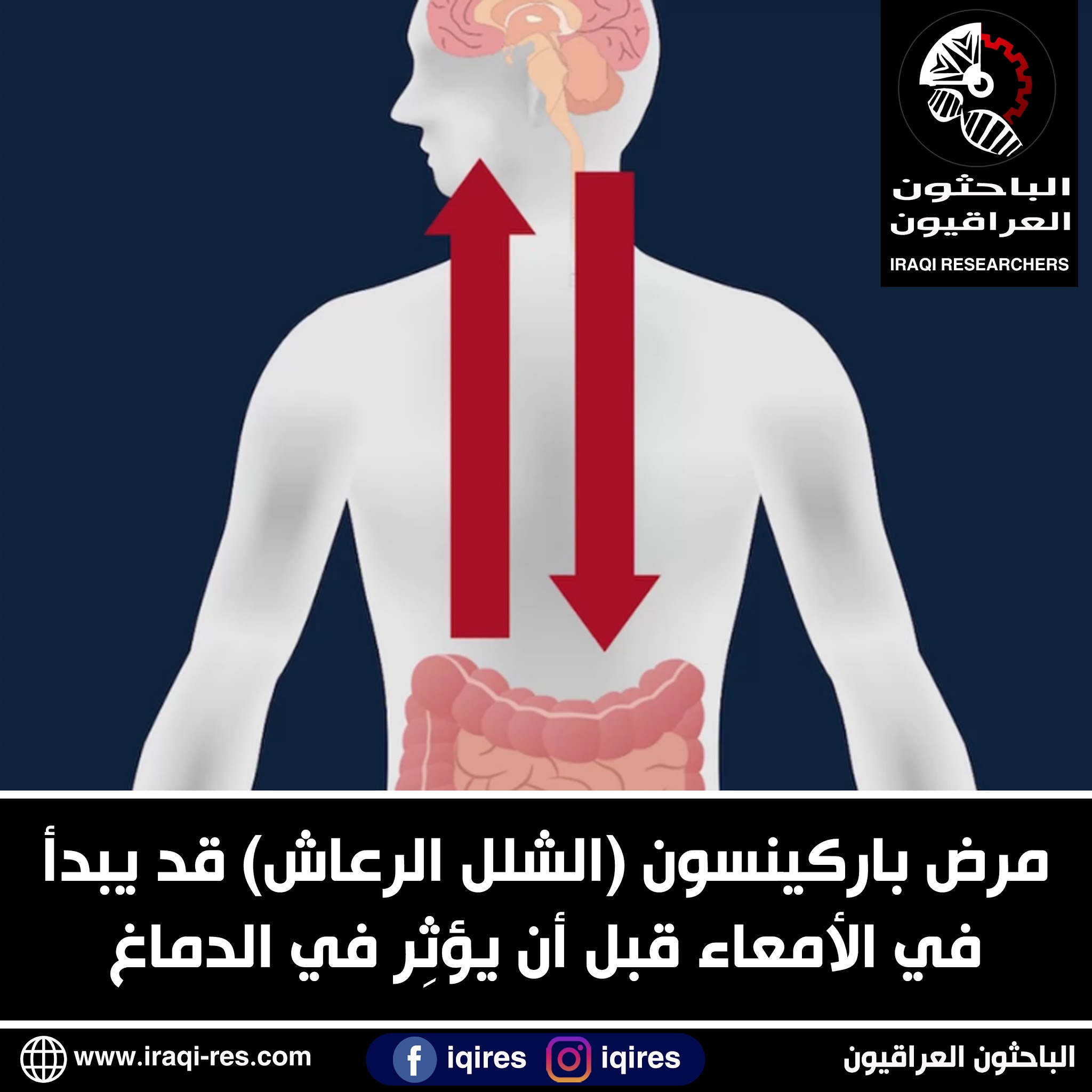
داء الشلل الرعاش، والذي يتضمن فشلاً وظيفياً و موتاً للخلايا العصبية في الدماغ، يمكن أن يكون منشأه من الامعاء . عدد من البحوث تُشير الى ذلك مدعمةً بعدد متزايد من الأدلة.
أظهرت الدراسات الجديدة نوعاً من البروتينات في الخلايا العصبية، و الذي يُصبح تالفاً و من ثم يتكتل في أدمغة الأشخاص المصابين بداء الشلل الرعاش، هذا البروتين تم ايجاده في خلايا بطانة الامعاء الدقيقة. البحث أُجريَ على كلٍ من خلايا الفئران و الخلايا البشرية .
النتائج تدعم النظرية التي تقول بأن هذا البروتين يتغير(يتلف) في الامعاء ثم ينتقل الى الدماغ حيث يؤدي لظهور أعراض المرض .
داء الشلل الرعاش هو من الامراض التي تؤثر على الحركة و تزيد شدته بصورة تدريجية . يصيب هذا المرض 1 مليون شخص في امريكا و 7-10 مليوم شخص حول العالم و ذلك حسب مؤسسة مرض باركنسون (Parkinson’s Disease Foundation).
أسم البروتين الذي يتلف ألفا-سينوكلين(alpha-synuclein) يتواجد بكُثرة في الدماغ. يذوب هذا البروتين في السائل الخلوي للخلايا العصبية السليمة. و لكن في المرضى المصابين بداء الشلل الرعاش يُصبح هذا البروتين مُلتَفاً بصورة غير طبيعية و من ثم ينتقل خلال الجهاز العصبي الى الدماغ مثل البريونات(و هي عبارة عن جزيئات بروتينية تُسبب تغيرات متسلسلة تنتج عنها تغيرات وضيفية) او بروتينات مُعدية(تستخدم بواسطة البكتيريا و الفيروسات وتنتج عنها الأمراض). تتجمع جزيئات هذا البروتين و تتكتل و نتيجة لذلك ينتج ضرر في الخلايا العصبية.
في دراسة أُجريت عام 2005 ذكر الباحثون أن المرضى المصابين بداء الشلل الرعاش تتواجد عندهم هذه التكتلات في خلاياهم الدماغية كما تتواجد ايضاً في خلايا بطانة أمعائهم . في دراسة أخرى أُجريت هذه السنة سلطت الضوء على المرضى المصابين بالقُرحة و الذين خضعوا لعملية جراحية لفصل العصب المبهم و الذي يربط الدماغ بالأمعاء . هؤلاء المرضى الذين خضعوا للجراحة قلَّت نسبة إصابتهم بداء الشلل الرعاش بنسبة 40% مقارنة بالاشخاص الذين لم يخضعوا لعملية فصل العصب.
كل من النتائج السابقة تُشير الى ان المرض ينتج من الامعاء.
لكن بقيت أحجية واحدة و هي : كيف أن هذه البروتينات تتلف في الأمعاء و من ثم تنتقل الى الدماغ. هذه البروتينات تتواجد في جوف الامعاء لكن “الاعصاب التي تغذي الامعاء لا تتصل اتصالاً مباشراً بجوفها” هكذا قال اخصائي امراض الجهاز الهضمي دكتور رودجر ليدل(Dr. Rodger Liddle) المؤلف الرئيسي للمقالة التي كُتبت في مجلة (JCI) و البروفيسور في جامعة ديوك (Duke University) في شمال كارولينا.
و في عام 2015 ظهر دليل على إمكانية انتقال البروتين من جوف الامعاء الى الخلايا العصبية، إكتشف فريق الباحث ليدل خلايا في بطانة الامعاء الدقيقة و التي كما قال ليدل : “تعمل بشكل مماثل تقريباً للخلايا العصبية”. ان الخلايا كانت خلايا غُدِّية أي انها تفرز هرمونات لكن هذه الخلايا تحتوي على نواقل عصبية و بروتينات اخري توجد عادة في الخلايا العصبية. و تُظهر هذه الخلايا تفرعات مُشابهة لتفرعات الخلايا العصبية التي تستخدمها للتواصل فيما بينها.
و عندما وُضِعت هذه الخلايا (الغُدَّية) بجانب الخلايا العصبية (مُختبرياً) أظهرت عملاً مماثلاً للخلايا العصبية و تحركت باتجاهها و نبتت الياف رابطة بين الخليتين حسب قول ليدل تم تصوير هذه العملية عام 2015 في مجلة التحقيق السريري (Journal of Clinical Investigation) الفيديو لمن يريد المشاهدة من هنا.
و قد قال ليدل:”بعد وضع هذه الخلايا معاً أظهرت سلوكاً مماثلاً للخلايا العصبية ولهذا السبب فلنرى إذا ما كانت هذه الخلايا تحتوي البروتين ألفا-سينكولين و اذا احتوته فهذا يعني انه من الممكن ان تكون المصدر لداء الشلل الرعاش “.
و أضاف ليدل أيضاً :”و الآن بعد إظهار فريق البحث ان هذه الخلايا بالفعل تحتوي على البروتين ألفا-سينكولين يسعى الباحثون الآن لمعرفة هل خلايا الغُدّد الصماء الموجودة عند مرضى داء الشلل الرعاش تحتوي على الهيئة التالفة من هذا البروتين” .
و يُضيف ليدل: “إذا أمكنهم ذلك فسيكون بامكانهم تصور كيفية انتقال البروتين المسبب للمرض من بطانة الامعاء الى الدماغ خلال العصب المُبهم”.
أظهرت بحوث سابقة أن الناس الذين يتعرضون لانواع معينة من البكتيريا و المبيدات الحشرية يكونون اكثر عرضة للإصابة بالمرض و قال ليدل: “هناك احتمالية واحدة و هي أن هذه العوامل تؤثر على الخلايا الغُدِّية المماثلة للخلايا العصبية مؤدية الى تغير هيئة البروتين و بالتالي تلف البروتين ألفا-سينكولين في بطانة الامعاء” .
و أضاف : “من الممكن ان تكون البكيريا او المواد السامة التي تهضمها الناس هي ما تؤثر على هذه الخلايا مؤدية الى تلف البروتين و الذي ينتقل للدماغ”.
الى الآن توجد العديد من الاحتمالات. لكن اذا دعمت البحوث القادمة هذه النظرية، يمكن ان يُبشر ذلك بطرق جديدة للتشخيص المبكر لداء الشلل الرعاش و علاجه.
اذا كانت بداية المرض من الامعاء فبالإمكان صنع علاج يمنع تلف البروتين في هذه الخلايا. و بالامكان انشاء نظام غدائي لعلاج هذه الخلايا في هذه المرحلة تخيُل هذا صعب لكن سنرى النتائج في المستقبل.
ترجمة: Omar Alfarooq
تدقيق و تصميم: Tabarek A. Abdulabbas
المصدر: هنا

 الباحثون العراقيون Iraqi Researchers
الباحثون العراقيون Iraqi Researchers

